(fuerte o débil) 1 Ver respuesta Publicidad Publicidad amymilanesa está esperando tu ayuda Añade tu respuesta y gana puntos alissonariana2301 alissonariana2301 Respuesta En el grupo de las sales de base fuerte y ácido débil encontramos entre otras, el carbonato de sodio ( Na2CO3), el bicarbonato de sodio (Un ácido débil es aquel ácido que no está totalmente disociado en una disolución acuosa 1 Aporta iones al medio, pero también es capaz de aceptarlos Si representáramos el ácido con la fórmula general HA, en una disolución acuosa una cantidad significativa de HA permanece sin disociar, mientras que el resto del ácido se disociará en iones positivos y negativos , formando unEl ácido fluorhídrico es el único ácido hidrohálico (como hcl, hi) que no es un ácido fuerte hf ioniza en una solución acuosa como otros ácidos hf h 2 o ⇆ h 3 o f el fluoruro de hidrógeno en realidad se disuelve bastante libremente en agua, pero los iones h 3 o y f se atraen fuertemente entre sí y forman el par fuertemente unido, h 3 o f Debido a que el ion

5 Ejemplos De Acidos Fuertes Y Uno Debil Brainly Lat
Hi acido fuerte o debil
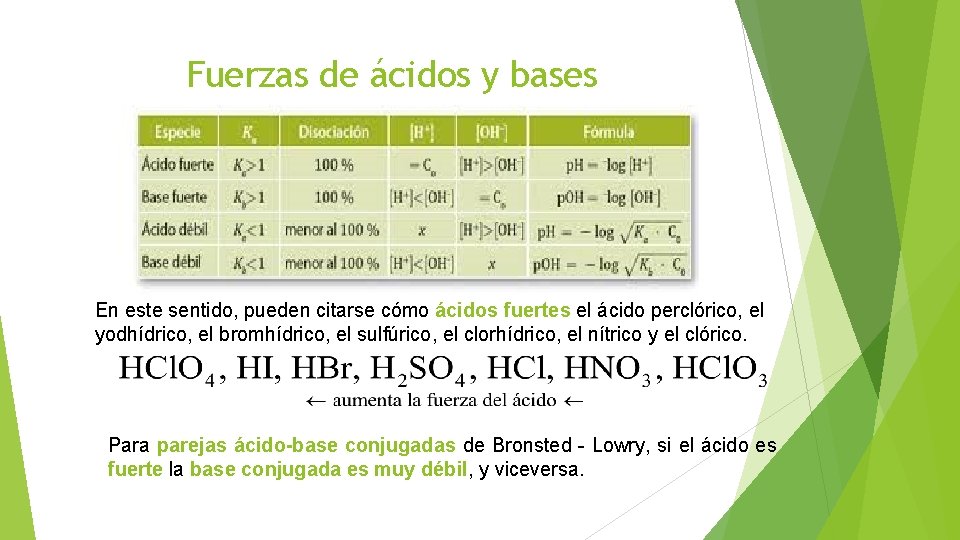
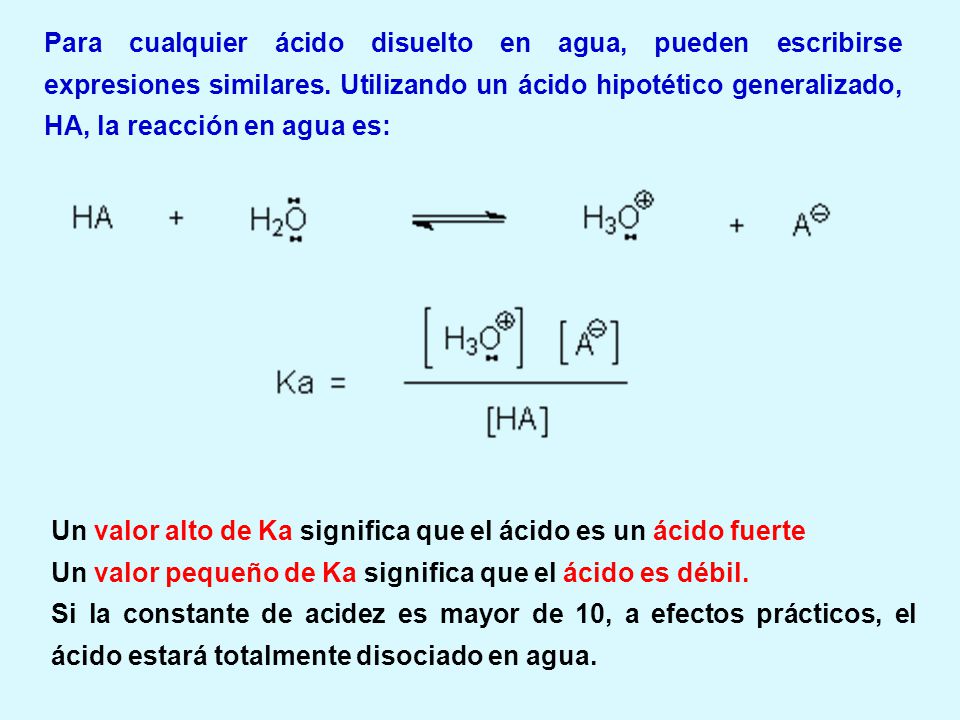
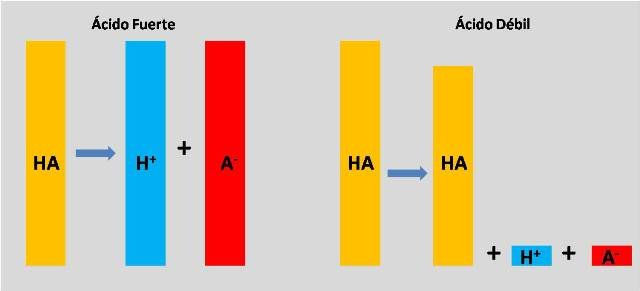
Hi acido fuerte o debil-Se dice que un ácido es fuerte si se disocia o ioniza completamente en una solución Eso significa que es capaz de dar el mayor número de iones H o protones cuando se mezcla en una solución Estos iones son las partículas cargadas Dado que un ácido fuerte dona una mayor cantidad de iones a medida que se descompone o ioniza, eso significa que un ácido fuerte es un conductorRecordemos que un ácido es fuerte o débil dependiendo de la cantidad de concentración que tenga de iónes de H El cual indica el PH que tendrá el compuesto químico Recordemos que el PH es una medida de la acidez o



3 6 2 Fortaleza De Acidos Quimica General
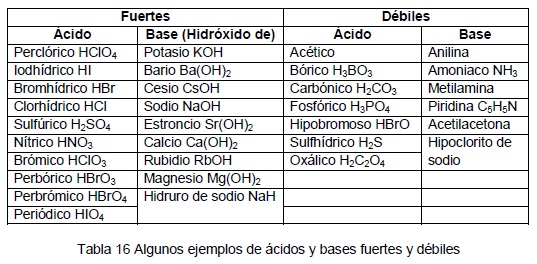
Solución Debido a que el HCl aparece en la tabla 122 «Ácidos y bases fuertes», es un ácido fuerte Debido a que el Mg(OH)2 aparece en la tabla 122 «Ácidos y Bases Fuertes», es una base fuerteNaoh (hidróxido de sodio o lejía), es una base fuerte en naoh, el átomo de oxígeno ha recibido el único electrón de la capa externa del electrón del átomo de sodio y comparte el electrón del átomo de hidrógeno para formar el compuesto como resultado, el ion hidróxido tiene una carga negativa de uno, y el ion sodio con una carga de más uno es atraído por él en solución, las2 Ver respuestas Publicidad Publicidad KimberlyCarmona KimberlyCarmona Respuesta Este oxoácido es moderadamente soluble en agua, aumentando la solubilidad en agua caliente En disolución acuosa se comporta como ácido monoprótico débil, lo cual es debido al fuerte carácter aceptor electrónico del boro (como
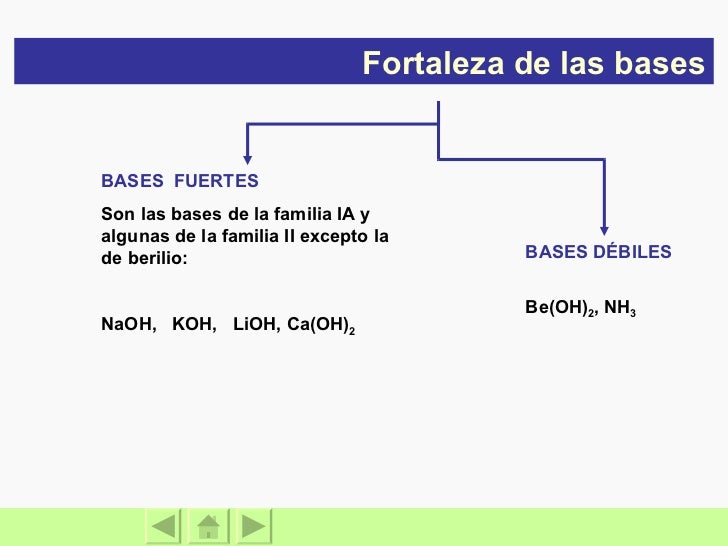
2 Ver respuestas Publicidad Publicidad sofiamartinivm sofiamartinivm Respuesta puede ser debil o fuerte Explicación Un ácido fuerte puede ser un electrolito débil o fuerte, ya que tanto ácidos como bases pueden llegar a ser buenos conductores El agua pura no es un electrolito y no es capaz Un acido fuerte ¿es un electrolito debil o Fuerte?Un ácido fuerte, como el ácido clorhídrico HCl, se ioniza de la siguiente
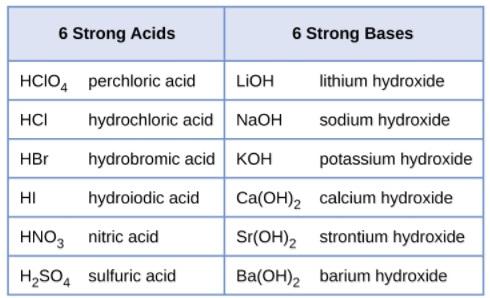
HI KOH HNO3 RbOH H2SO4 CsOH HClO3 Mg(OH)2 HClO4 Ca(OH)2 Sr(OH)2 Ba(OH)2 Ejemplo 6 Identifica cada ácido o base como fuerte o débil HCl; Ácidos y bases fuertes Un ácido o una base son fuertes cuando en un medio acuoso se disocian completamente, es decir, el proceso de ionización es total y en la solución se encontrará la misma concentración de aniones que de cationes ¿Cómo se ioniza un ácido y una base fuerte?Uno diluido tiene poca cantidad de ácido Por ejemplo, si se tiene ácido acético 12M (concentración de 12 moles



Acidos Y Bases



Reacciones De Transferencia Cidobase Profesora Roxana Reinoso Caro
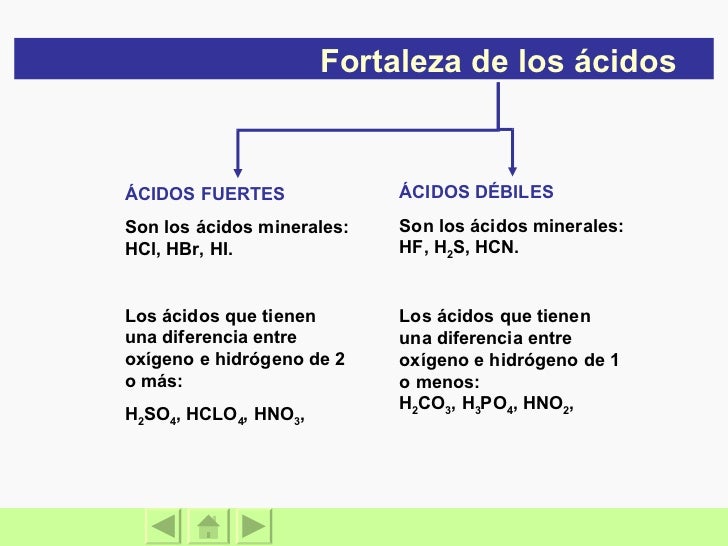
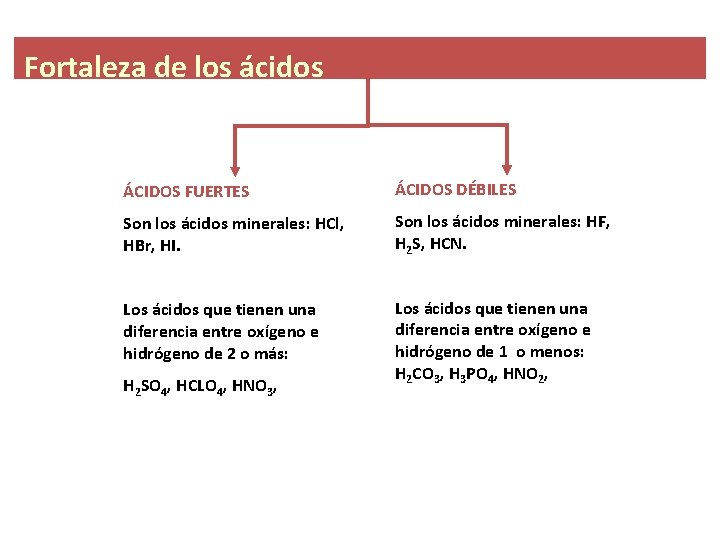
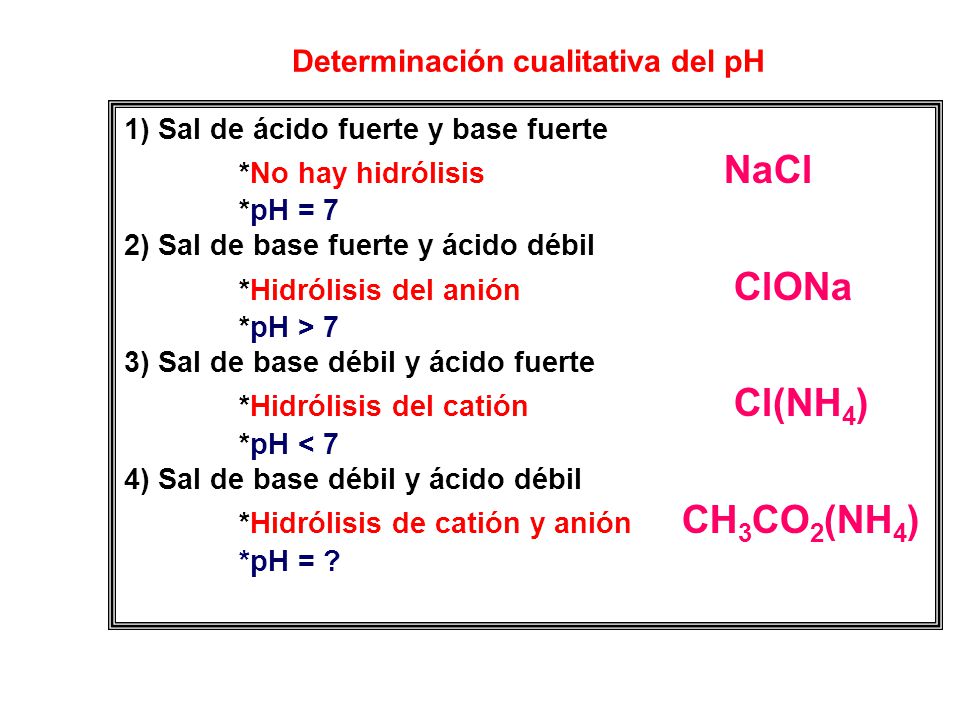
ACIDOS FUERTES Y DEBILES CARACTERISTICAS Y PROPIEDADES Tienen sabor agrio Na2Co3 es acido o base? Fuerte o débil en relación con concentrado o diluido Hay que tener cuidado para no confundir los términos fuerte y débil con concentrado y diluido Un ácido concentrado tiene gran cantidad de ácido en la solución acuosa;




Acidos Y Bases Bronsted Lowry Bronsted Lowry En 1923 El Danes Johannes Nicolaus Bronsted Y El Ingles Thomas Lowry Introdujeron Una Nueva Teoria Acerca De Los Acidos Y Las Bases Que Mejoraba La Anterior De Arrhenius Resolviendo Algunas




5 Ejemplos De Acidos Fuertes Y Uno Debil Brainly Lat
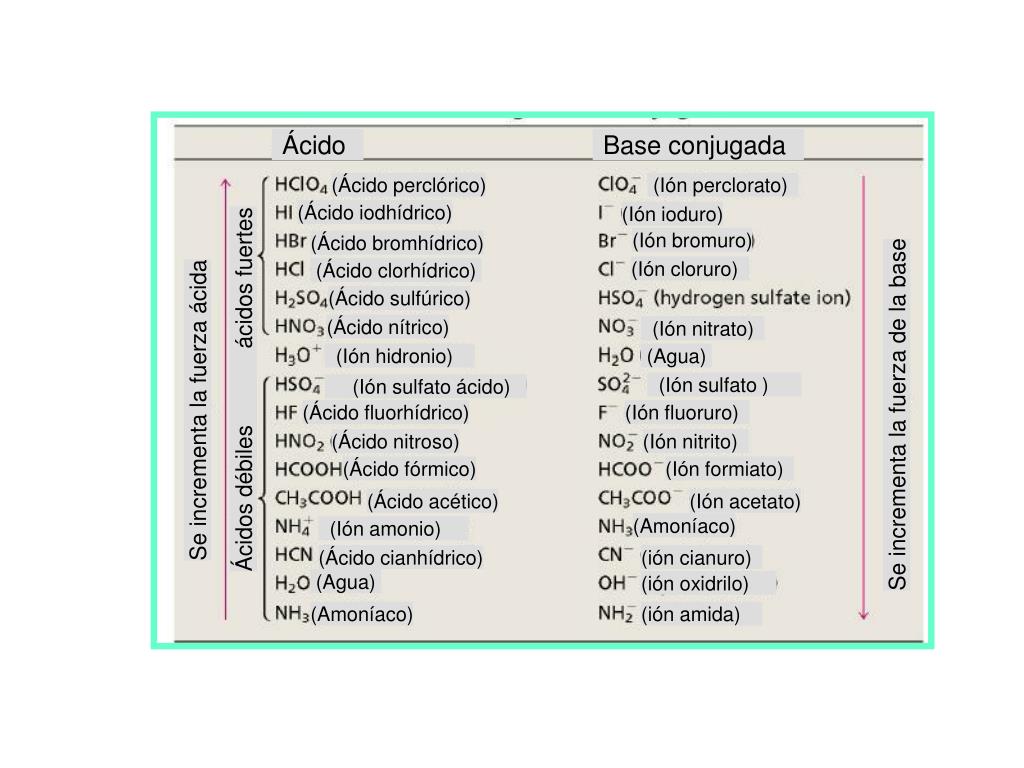
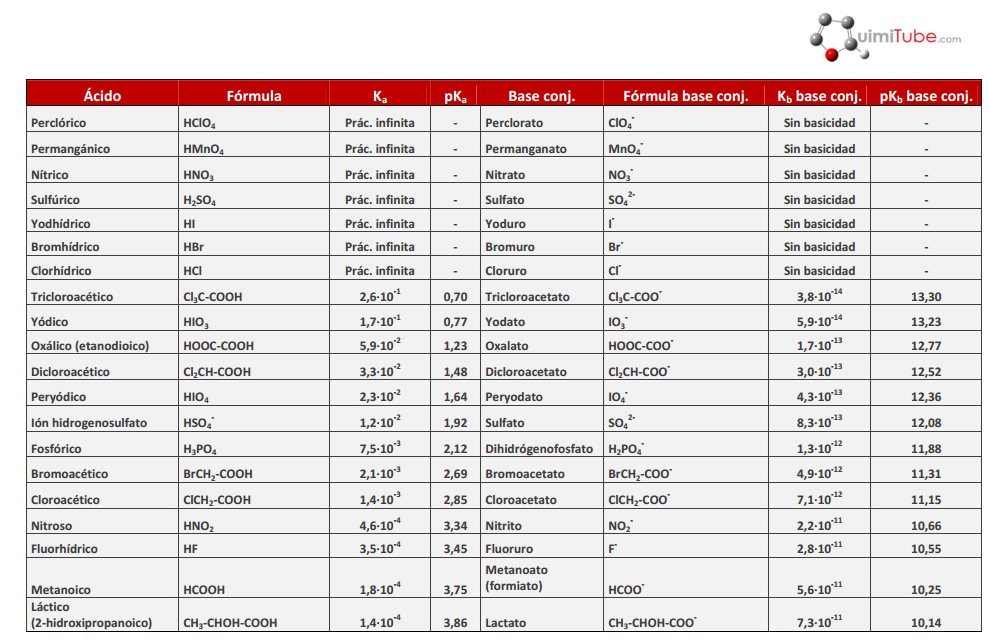
A continuación se describe que ácido es fuerte o débil H2Se > Débil ; El ácido bórico es ¿ácido fuerte o débil?Química Ácidos y Bases Español Un ácido es una solución que tiene un exceso de hidrógeno (H ) iones Una base es una solución que tiene un exceso de hidróxido (OH) los iones Otra palabra para la base es alcalino La fuerza de un ácido o base puede ser fuerte o débil *Un ácido que tiene un pH muy bajo (04) se conocen como



Acidos Y Bases En Las Reacciones Organicas Acido Y Base Segun Bronsted Lowry Acido Especie Capaz De Donar Un Ion H Base Especie Capaz De Aceptar Union Ppt Descargar




Chem I2 Flashcards Quizlet
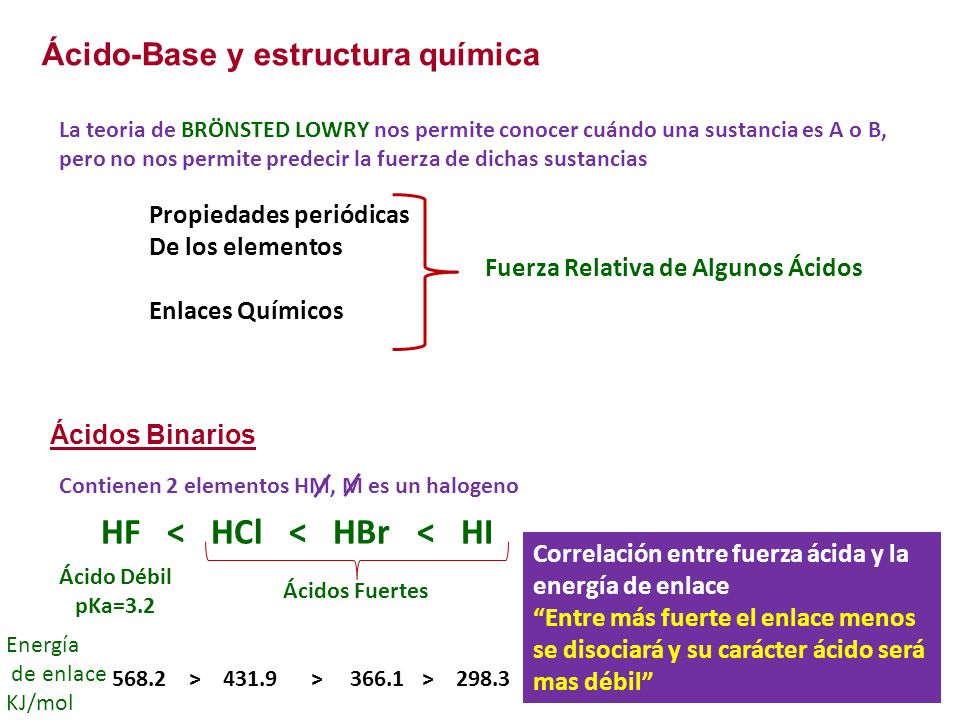
Entonces, HI es más fuerte que HF Sharad Pratap Singh La acidez se basa en el concepto de diferencia en las cargas negativas (Q / V) de catión y anión Más alta la diferencia mejor es el ácido H es relativamente un ion pequeño En comparación con h , f es más comparable en tamaño que cl Por lo tanto, HI es un mejor ácido que HF Vinay Shimpi El tamaño de I es mayor que FModelo CPK del ácido fluorhídrico (verde fluor, blanco hidrógeno) 3 El ion pequeño de carga grande F, que se forma cuando se ioniza el HF, hace que aumente el ordenamiento de las moléculas de agua, cuyo amento es desfavorable al proceso de ionización 2 La fuerza de enlace esPor ejemplo, HF se disocia en H y Fiones en agua, pero algo de HF permanece en solución, por lo que no es un ácido fuerte Hay muchos más ácidos débiles que ácidos fuertes La mayoría de los ácidos orgánicos son ácidos débiles Aquí hay una lista parcial, ordenada de más fuerte a más débil HO 2 C 2 O 2 H ácido oxálico



Depa Fquim Unam Mx




Acidos Comunes Fuertes Y Debiles Y Formas De Diferenciarlos




Acidos Y Bases Bronsted Lowry Bronsted Lowry En 1923 El Danes Johannes Nicolaus Bronsted Y El Ingles Thomas Lowry Introdujeron Una Nueva Teoria Acerca De Los Acidos Y Las Bases Que Mejoraba La Anterior De Arrhenius Resolviendo Algunas




Clase Auxiliar 10 Prof Mauricio Morel Auxiliares Nicolas Carvajal Ppt Descargar




Acido Debil Reaccion De Disociacion Quimica Wikisabio



Equilibrio Qumico Reacciones Cido Base Cidos Caractersticas Tienen




Examen 1 Correccion



Hi Es Mas Acido Que Hbr Por Que La Ciencia Y La Tecnologia Mejoran El Futuro



Mapa Conceptual De Acido Tankekarta Exempel




Doc Ano Del Buen Servicio Al Ciudadano Acidos Y Bases Fuertes Y Debiles Semejanzas Y Diferencias Ana Lucero Miranda Cardenas Academia Edu




Acidos Y Bases De Bronsted 15 1 Defina Los Acidos Y Bases De




Acidos Bases Fuertes Y Debiles Ka Constante De Disociacion Acida 1a Parte Youtube



1



Acidos Y Bases



Colegioconcepcionsanpedro Cl




Pdf Acidos Y Bases Keimy Hernandez Llanos Academia Edu




Unidad 2 Acido Base Tema Fuerza Relativa De Los Acidos Y Las Bases Objetivo Explicar La Fuerza Relativa De Acidos Y Bases Determinar El Ph De Acidos Ppt Descargar




Acidos Y Bases Bronsted Lowry Bronsted Lowry En 1923 El Danes Johannes Nicolaus Bronsted Y El Ingles Thomas Lowry Introdujeron Una Nueva Teoria Acerca De Los Acidos Y Las Bases Que Mejoraba La Anterior De Arrhenius Resolviendo Algunas



Clase 4 Ha B Hb A Si El Acido Ha Y La Base B Son Fuertes El Equilibrio Se Desplazara R P Si Son Debiles Ambos La Rxn




Fuerza De Los Acidos Y Las Bases I Ejemplos I Tablas



Asidos Fuertes Y Debiles Quimica Ii Christian Osiel Lee




Tema 6 Acidos Y Bases Pdf Descargar Libre




Mezcla De Acido Fuerte Y Acido Debil Youtube




Lista De Acidos Fuertes Y Debiles Comunes Interesante 21




Ejer Resueltos2 Catedu



3 6 2 Fortaleza De Acidos Quimica General



Ionizacion De Acidos Y Bases



Fq Iespm Es



Ugr Es




Calculo Del Ph En Disoluciones Acuosas




Acidos Bases Fuertes Y Debiles Ka Constante De Disociacion Acida 1a Parte Youtube




Fisica Quimica Acidos Fuertes Y Debiles Constante De Acidez Acidos Poliproticos




Propiedades De Acidos Y Bases



Ppt Acidos Y Bases Powerpoint Presentation Free Download Id




16 6 Acidos Debiles La Fisica Y Quimica
/list-of-strong-and-weak-acids-603642-v2copy2-5b47abd0c9e77c001a395e55.png)



Acidos Comunes Fuertes Y Debiles Y Formas De Diferenciarlos




Ppt Fuerza De Acidos Y Bases Powerpoint Presentation Free Download Id




Variacion Del P H En Las Titulaciones De Acido Base Variacion De P H En Las Titulaciones Acido Base




Acidos Y Bases Arrhenius Neutralizacion Ha Acido Ha H A Ppt Descargar




Fuerza De Acidos Y Bases Ppt Descargar




Acidos Bases Y Electrolitos Semana Nmero 12 17



1



Fuerza De Acidos Y Bases Quimica




Diferencia Entre Acido Fuerte Y Debil




El Acido Acetico Hc2h3o2 Es Un A Acido Fuerte B Acido Debil C Base Fuerte D Base Debil Brainly Lat




Nombra Los Acidos Fuertes Y El Acido Mas Fuerte Del Mundo Interesante 21




16 5 Acidos Y Bases Fuertes La Fisica Y Quimica




Acidos Y Bases Capitulo Ppt Descargar



Acidos Y Bases




Diferencia Entre Acido Debil Y Fuerte Compare La Diferencia Entre Terminos Similares Ciencias 21




El Fisico Loco Acido Fuerte Acido Debil



Diferencia Entre Una Base Debil Y Una Base Fuerte Esta Diferencia




Titulacion De Una Base Debil Con Un Acido Fuerte Video Khan Academy




Acido Fuerte Y Debil Base Fuerte Y Debil Pdf Acido Ramas De La Termodinamica




Calameo Boletin 10 Quimica Iv




Universidad De La Frontera Fac Ing Cs Y Adm Dpto Cs Quimicas Ppt Descargar




Calameo Tabla Con Algunos Pares Conjugados Acido




Fisica Quimica Acidos Fuertes Y Debiles Constante De Acidez Acidos Poliproticos




Acidos Y Bases Bronsted Lowry Bronsted Lowry En 1923 El Danes Johannes Nicolaus Bronsted Y El Ingles Thomas Lowry Introdujeron Una Nueva Teoria Acerca De Los Acidos Y Las Bases Que Mejoraba La Anterior De Arrhenius Resolviendo Algunas




Ppt Fuerza De Acidos Y Bases Powerpoint Presentation Free Download Id




2 1 Acidos Y Bases Fuertes Y Debiles



Nanopdf Com




Docencia Y Divulgacion Today



1




Nomenclatura De Acidos Y Bases Pdf




Acidos Fuertes Y Debiles Cuales Son Y Como Los Diferenciamos Yubrain




Informe De Cuestionario Seminario 6 Pdf Acido Electrolito




Acidos Fuertes Y Debiles Caracteristicas Quimica Analitica Qa1 Studocu




Ejercicios De Titulacion Base Fuerte Acido Debil Youtube




Ejercicios Resueltos Y Propuestos




Guia Acidos Y Bases



Ugr Es



Quimiziencia Es




Calameo Quimica Evaluacion 5




Disoluciones De Acidos Fuertes Y Debiles Cienciadelux




Ejercicios Resueltos Y Propuestos



Acidos Debiles En Nuestra Vida Cotidiana Caracteristicas Y Donde Encontrarlos Steemit



Ugr Es



Laboralfq Files Wordpress Com



Fq Iespm Es



Algunos Acidos Y Bases Fuertes De Aparicion Comun En Ejercicios Quimitube



Colegioconcepcionsanpedro Cl




Fuerza De Acidos Y Bases Quimica




El Acido Fluorhidrico Puede Disolver El Vidrio Pero Es Considerado Un Acido Debil Quimica En Casa Com



Acidos Y Bases Arrhenius Neutralizacion Ha Acido Ha H A Ppt Descargar



Quimica3001 Quimicageneralipsipo Weebly Com
/hydrofluoric-acid-molecule-147216065-5a7b7d47ba61770036b929f4.jpg)



Por Que El Acido Fluorhidrico Es Un Acido Debil




El Grafico A Continuacion Corresponde A La Valoracion Conductimetrica De Un Acido Fuerte Pdf Valoracion Quimica




Titulacion De Un Acido Debil Con Una Base Fuerte Video Khan Academy



Ramonhernandezacademicresources Weebly Com




9 Reacciones Acido Base Pdf Free Download




Calculo Del Ph De Un Acido Fuerte Youtube




Ppt Reacciones De Transferencia De Protones Acido Base 2 Bach Powerpoint Presentation Id
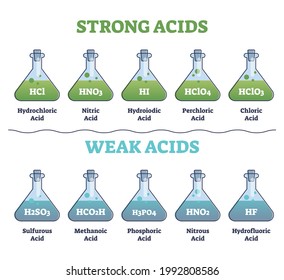



Acido Clorico Imagenes Fotos De Stock Y Vectores Shutterstock




Acidos Fuertes Y Debiles Caracteristicas Y Propiedades Tienen Sabor Agrio Frank Samuel Gti Academia Edu



Quimicaitatljmm Files Wordpress Com
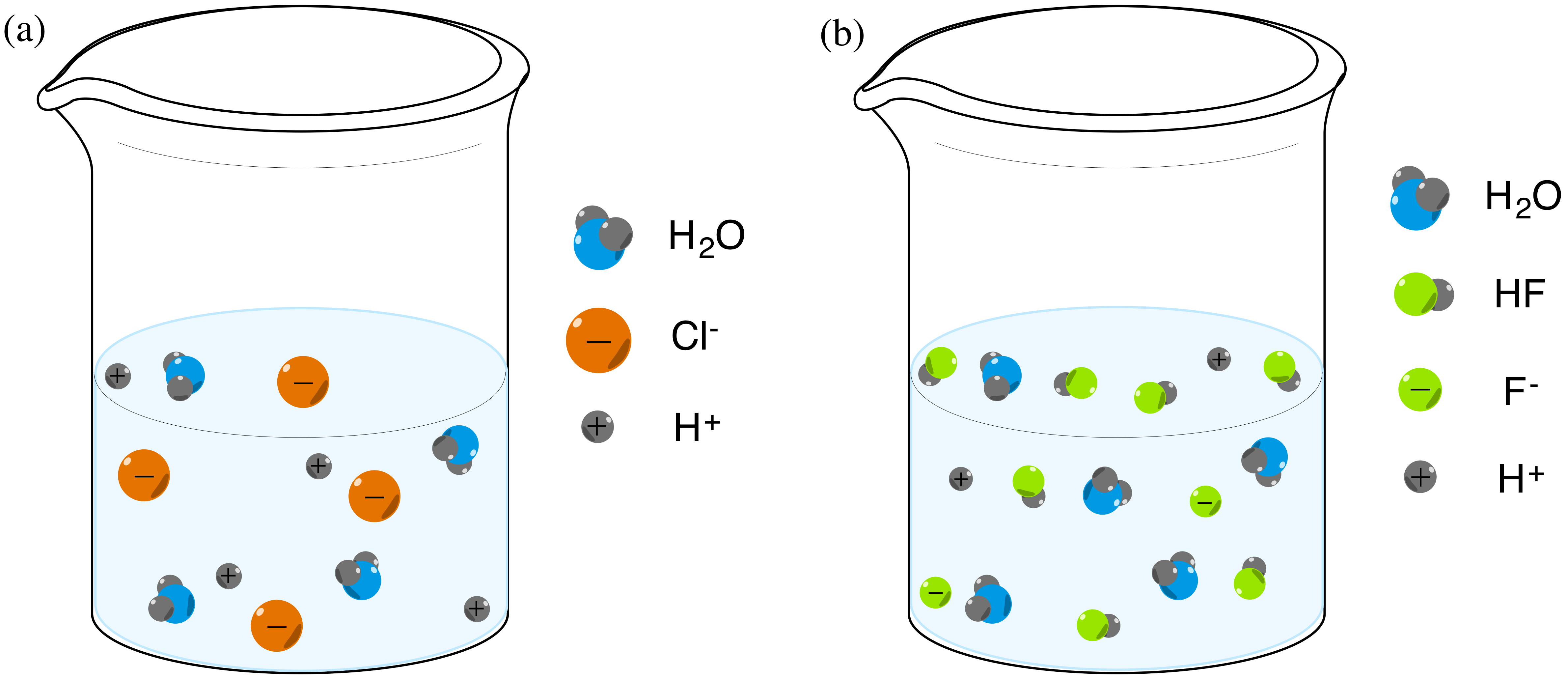



Acidos Y Bases De Bronsted Lowry Articulo Khan Academy



Tomi Digital



0 件のコメント:
コメントを投稿